10月1日、朝日新聞が「筋萎縮性側索硬化症(ALS)患者を対象としたボスチニブ第1相試験でよい結果が得られた」と報じました。その関連資料が協会本部から送られてきましたのでご紹介します。
<筋萎縮性側索硬化症(ALS)患者さんを対象とした
ボスチニブ第1相試験のご報告 ~ALS進行停止を目指すiDReAM Study~>
2021年10月1日
1. 概要
京都大学iPS細胞研究所(CiRA)の井上治久教授、徳島大学病院脳神経内科 和泉唯信教授、京都大学医学部附属病院脳神経内科 髙橋良輔教授、北里大学病院脳神経内科 永井真貴子診療准教授、鳥取大学医学部附属病院脳神経内科 渡辺保裕准教授らの研究チームは、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験注1」(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine study)を行い、ボスチニブの安全性と忍容性注2を評価し、探索的に有効性評価を行いました。
同チームはALS患者さんのiPS細胞を用いて、2012年にALSの病態再現、2017年に薬剤スクリーニングのためのiMNシステム注3を開発し、慢性骨髄性白血病の治療薬であるボスチニブが強い抗ALS病態作用を有することを見出しました。
2019年より開始した本臨床試験に参加された患者さんの人数に限りがあるものの、ボスチニブにALS特有の有害事象注4は認めなかったこと、ボスチニブの投与期間に一部の患者さんでALSの進行の停止が見られたこと、その目印となる可能性のある指標があったことを、見出しました。
今後、iPS創薬注5から展開した本臨床試験の結果に基づいて、多くのALS患者さんを対象としてボスチニブの有効性を調べるために、十分な安全性を考慮した上で、次相以降の試験を計画しています。
2. 研究の背景
筋萎縮性側索硬化症(ALS)は、運動神経細胞が変性して筋萎縮と筋力低下を来す進行性の疾患で、経過に個人差はあるものの、人工呼吸器を使用されなければ、発症から数年で落命される疾患です。ALSの進行を緩和する既存薬はありますが、いまだALS の進行を停止する根本的治療は確立されていません。
これまで、研究チームは、ALS患者さん由来のiPS細胞から作製した運動神経細胞を用いて、ALSの病態を再現できることを見出し(参照:CiRAプレスリリース 2012年8月1日)、さらに、ALSの病態の中核である運動神経細胞の細胞死と異常タンパク質の蓄積を抑えることができる化合物のスクリーニングを行うiMNシステムを構築しました(参照:CiRAプレスリリース 2017年5月25日)。このシステムを用いて、既に他の疾患で治療薬として用いられている物質を含むさまざまな種類の化合物をスクリーニングした結果、強い抗ALS病態効果を有するボスチニブを同定し報告しました。ボスチニブ(販売名:ボシュリフ®錠)は、慢性骨髄性白血病の治療薬として用いられている既存薬です。
慢性骨髄性白血病においてボスチニブは1日量として、前治療歴に応じて通常500mgまたは400mgが投与されます。また、患者さんの状態により適宜増減され、最大1日量として600mgまで投与可能です。一方、ボスチニブはALSを適応症として日本および世界各国で承認されておらず、ALSに対する有効性、安全性ならびに適切な用量は確立していません。そのため、ボスチニブは現時点でALSの治療薬として使用できる状況にありません。
研究チームは、2019年から、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験」(iDReAM試験)を行い(参照:CiRAプレスリリース 2019年4月23日)、ALS患者さんにおけるボスチニブの安全性と忍容性を評価し、探索的に有効性を評価しました。
3. 研究結果
本試験においては、12名の患者さんについてALS特有の有害事象が生じる可能性がないか調べるために、はじめに3名のALS患者さんに1日量100mg投与し、その結果を安全性評価委員会注6で評価を行った後、次に、別のALS患者さん3名に1日量200mg、同様に次に別のALS患者さん3名に1日量300mg、次に別のALS患者さん3名に1日量400mgを投与する試験を実施しました。
結果として、ボスチニブ1日量100mg~300mgを投与されたALS患者さん9名が12週間の試験を完了しました。1日量400mgを投与されたALS患者さん3名が有害事象により試験を完了しませんでした。全体を通じての有害事象としては、下痢、肝機能障害などが見られました。治験実施計画書に規定した基準に基づき、適切なボスチニブの投与調整や支持療法による管理が必要な場合がありました。
ALS患者さんにおけるボスチニブの有効性を探索するために、ALSの症状の進行を示す指標であるALSFRS-R注7の変化を調べました。ALSの症状が進行するとALSFRS-Rのスコアが低下します。ボスチニブを12 週間内服された9名の方のうち5名の方では、ボスチニブ内服後、ALSFRS-Rスコアの低下が停止していることが明らかになりました。ALSFRS-Rの低下が見られた4名の方と、ALSFRS-Rの低下の停止がみられた5名の方の血液を調べたところ、ボスチニブ投与前のニューロフィラメントL注8という物質の量が異なっていることがわかりました。

4. まとめ
以上の結果から、ALS患者さんで認められた有害事象の種類は慢性骨髄性白血病と同様であり(ボシュリフ錠 100 mg添付文書、2020年6月改訂)、ボスチニブの100mg~300mgの用量レベルでの忍容性は良好であることがわかりました。また治験実施計画書に規定した基準に基づき、適切なボスチニブの投与調整や支持療法による管理が必要な場合がありました。
探索的有効性解析注9では、ボスチニブの投与期間において、一部の患者さんでALSの進行の停止がみられたこと、その目印となる可能性がある指標があったことが明らかになりました。ただし、本臨床試験に参加された患者さんの人数に限りがあるため、更なる検討が必要であると考えます。 ボスチニブはALSを適応症として日本および世界各国で承認されておらず、ALSに対する有効性、安全性ならびに適切な用量は確立していません。そのため、ボスチニブは現時点でALSの治療薬として使用できる状況にありません。
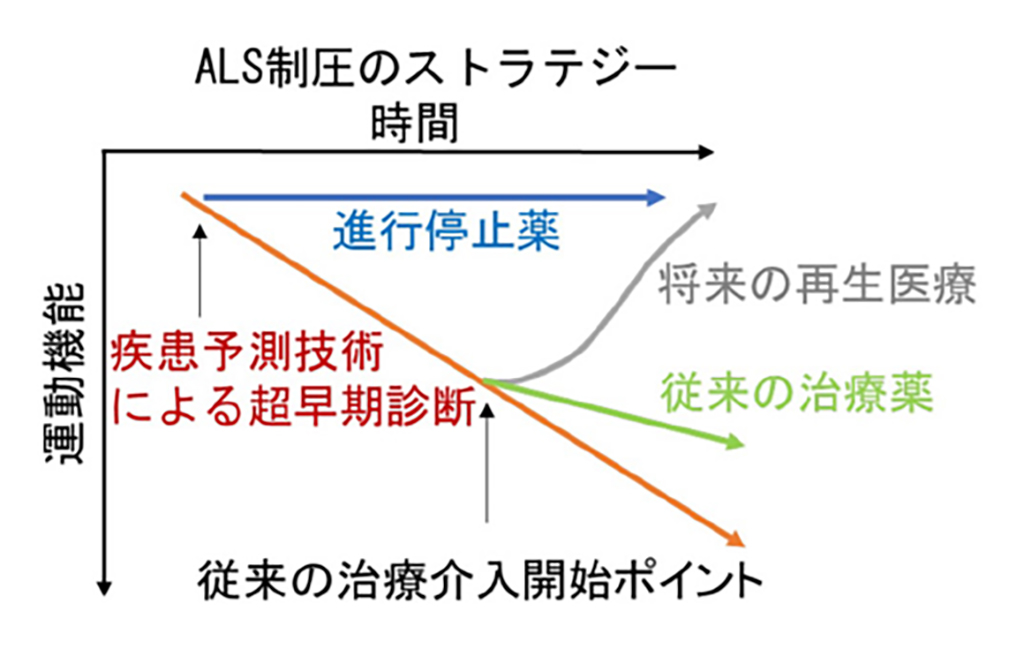
今後、多くの患者さんでボスチニブの有効性を調べるために、十分な安全性を考慮した上で、次相以降の試験を行うことを計画しています。将来的には、現在研究を進めているAIを用いた疾患予測技術(参照:CiRAプレスリリース2021年2月24日)と合わせてALS制圧を目指していきたいと考えています。
5. 用語説明
注1)筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験
筋萎縮性側索硬化症患者さんを対象としたボスチニブの医師主導治験。
注2)忍容性
薬の副作用が患者さんにとってどれだけ耐えられるものであるかの程度。
注3)iMNシステム
iPS細胞に3つの転写因子Lhx3, Ngn2, Isl1を導入し、迅速に運動神経細胞を作製する方法。iPS細胞から、短期間に再現性良く大量の運動神経細胞を作製でき、化合物のスクリーニング研究に適している。
注4)有害事象
薬を投与された患者さんに生じたあらゆる好ましくない徴候、症状、または病気。
注5)iPS創薬
iPS細胞を用いた治療薬研究。iPS細胞は患者さんの遺伝子情報を有しているため、患者さんの病気の特徴を再現した細胞で化合物の効果を調べることができ、患者さんの病態にあった薬を抽出可能である利点がある。
注6)安全性評価委員会
治験依頼者、治験責任医師及び治験調整医師から独立した立場で治験の安全性データを評価し、治験の継続、変更又は中止を提言する委員会。
注7)ALSFRS-R
ALS機能評価スケール改訂版(ALS functional rating scale-revised)。
注8)ニューロフィラメントL
ニューロフィラメント軽鎖(Neurofilament Light chain)。神経細胞の軸索突起に豊富に含まれる細胞骨格の成分である。
注9)探索的有効性解析
臨床試験の主要な目的に沿った解析以外に、結果を裏付けるために行う解析や、素材の新たな可能性を発見するための解析。





